Роль эозинофилов в развитии аллергии
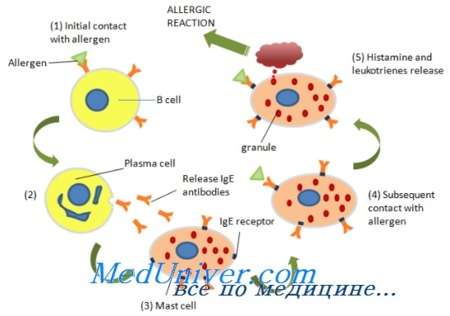
Иммуноглобулин Е (IgE) и эозинофилы в аллергической реакции
Развитие острой аллергической реакции зависит от IgE и его избирательного связывания с а-цепью высокоаффинного FceRI или низкоаффинного FceRII. Взаимодействие этих комплексов с аллергеном запускает сложный каскад внутриклеточных реакций, приводящих к дегрануляции тучных клеток или базофилов с высвобождением различных медиаторов аллергического воспаления.
Молекула FceRI присутствует и на поверхности дендритных АПК (например, клеток Лангерганса), но в отличие от FceRI не содержит b-цепи на тучных клетках и базофилах. Мононуклеары, эозинофилы, тромбоциты и ДК лимфатических узлов экспрессируют на своей поверхности CD23 (FceRII).
Синтез IgE происходит под влиянием двух основных сигналов. Начальный сигнал исходит от ИЛ-4 и ИЛ-13, которые активируют транскрипцию иммуноглобулинового локуса е в клетках зародышевой линии и тем самым определяют специфичность изотипа. Второй сигнал сводится к взаимодействию CD40 на В-лимфоцитах с лигандом CD40 на Т-лимфоцитах.
Это активирует механизм рекомбинации, приводящий к переключению генов, кодирующих синтез иммуноглобулинов. Сигнал, поступающий от связывания CD40, может быть заменен воздействием вируса Эпштейна-Барр или глюкокортикоидов. Взаимодействия различных участков костимуляторных молекул (CD28/B7, LFA-1/ICAM-1 и CD2/CD58) увеличивают интенсивность первого и второго сигналов, приводя к дальнейшему усилению синтеза IgE. К факторам, угнетающим синтез IgE, относятся цитокины Тh1-клеток (ИЛ-12, ИФН-а и ИФН-у) и микробная ДНК, содержащая цитидинфосфат-гуанозиновые повторы.

Эозинофилы при аллергической реакции
Для аллергических заболеваний характерна эозинофилия периферической крови и тканей. Эозинофилы содержат плотные гранулы с воспалительными белками — главным основным белком, эозинофильным нейротоксином, пероксидазой и катионным белком. Белки эозинофильных гранул, попадая в поврежденные эпителиальные клетки, повышают реактивность дыхательных путей и вызывают дегрануляцию базофилов и тучных клеток.
Главный основный белок эозинофилов связывается с кислой составляющей мускариновых рецепторов М2 и блокирует их функцию, что приводит к увеличению уровня ацетилхолина и повышению реактивности дыхательных путей. Эозинофилы содержат также большое количество лейкотриенов, особенно цистеиниллейкотриена С4, который сокращает гладкие мышцы и увеличивает проницаемость сосудов. К другим секреторным продуктам эозинофилов относятся цитокины (ИЛ-4, ИЛ-5, ФНО-а), протеолитические ферменты и активные формы кислорода; все они резко усиливают аллергическое воспаление тканей.
Функция эозинофилов при аллергии, в свою очередь, регулируется рядом цитокинов. В костном мозге эозинофилы развиваются из клеток-предшественниц, чувствительных к ИЛ-5. Воздействие аллергена у больных приводит к экспрессии рецептора ИЛ-5 на СD34-клетках костного мозга, и его связывание с ИЛ-5 стимулирует в эозинофилах синтез гранулярных белков, удлиняет их жизнь, усиливает дегрануляцию эозинофилов и ускоряет их выход из костного мозга в кровь.
ГМ-КСФ также стимулирует пролиферацию эозинофилов, продукцию ими цитокинов и дегрануляцию, продлевая срок жизни этих клеток. Некоторые хемокины (белки семейства RANTES, макрофагальный воспалительный белок 1а и эотаксины) играют важную роль в привлечении эозинофилов в очаги аллергического воспаления тканей. Так, эотаксины стимулируют выход ИЛ-5-зависимых колониеобразующих клеток-предшественниц эозинофилов из костного мозга. Эти клетки быстро исчезают из крови, либо возвращаясь в костный мозг, либо проникая в очаги воспаления в тканях.
— Также рекомендуем «Тучные клетки при аллергических реакциях»
Оглавление темы «Аллергические реакции у детей»:
- Иммуноглобулин Е (IgE) и эозинофилы в аллергической реакции
- Тучные клетки при аллергических реакциях
- Механизмы аллергических реакций. Патогенез аллергий
- Наследственные причины аллергий. Генетика атопий
- Эпидемиология (распространенность) аллергических заболеваний — атопий
- Беседа (сбор анамнеза) при аллергии у ребенка. Выявление аллергена
- Осмотр (физикальное обследование) ребенка с аллергиями
- Диагностика аллергий по эозинофилам и IgE — иммуноглобулину Е
- Кожные пробы с аллергенами у детей при аллергиях
- Оздоровление образа жизни у детей аллергиков. Жилье при аллергических заболеваниях
Источник
Морфология. В норме эозинофильные гранулоциты составляют 2- 4% от общего количества лейкоцитов периферической крови. Обычно диаметр эозинофилов несколько больше, чем у других гранулоцитов. Ядро сегментировано. Мембрана несет рецепторы для IgG, IgE и С3b. Их число значительно колеблется в зависимости от функционального назначения. Так, при воздействии хемотаксического стимула число С3b-рецепторов повышается. Цитоплазма содержит многочисленные гранулы, которые в нативном препарате имеют желтый цвет и двойное преломление (кристаллоид). Наиболее характерный признак — это их способность к окрашиванию эозином, Эозинофильные гранулы обычно резистентны к воздействию химических веществ. При цитохимическом исследовании была выявлена особая форма лизосом. Классическая гранула имеет мембрану и состоит из довольно плотного ядра (данные ультраструктурного анализа) и менее плотного матрикса. Ядро может принимать различные формы. Пероксидаза локализуется прежде всего в матриксе (гистохимический анализ). При более сильном увеличении микроскопа ядро можно распознать по продольному и поперечному преломлению. Основное вещество — богатый аргинином белок. Для другого типа гранул характерны малые размеры и отсутствие кристаллоида, но они содержат фосфатазу и арилсульфатазу. Третий тип гранул имеет самые большие размеры, нечетко видимую мембрану и неплотное яlро. Этот тип гранул обнаруживают прежде всего при синдроме гиперэозинофилии. По сравнению с другими гранулоцитами цитоплазма эозинофилов богаче вакуолями, рибосомами и митохондриями, что служит признаком высокой метаболической активности.
Среди щелочных белков гранулы особая роль принадлежит MBP. Этот белок присутствует в ядре кристаллоида. По сравнению с основным белком нейтрофилов он не обладает значительной антибактериальной активностью. В состав крупной гранулы входят гистаминаза и лизосомальные гидролазы. В малых гранулах обнаружены арилсульфатаза и кислая фосфатаза. Из фосфолипазы В микрогранул возникают кристаллы Шарко — Лейдена.
Наряду с преформированными медиаторами, которые высвобождаются при дегрануляции, в эозинофилах присутствуют производные арахидоновой кислоты, реализующие активность через 5-липоксигеназу, а также через другой путь — 15-липоксигеназу.
Через 2-6 дней эозинофилы созревают в костном мозге и поступают в кровь, а затем с «полупериодом» 6-12 ч в различные ткани. Время их жизни несколько дольше, чем у нейтрофилов. На эозинофилы крови приходится 300 дней в костном мозге и 100-300 дней в других тканях (прежде всего на слизистых оболочках). ФАТ оказывает хемотаксическое действие на эозинофилы. Их распад происходит в клетках моноцитарно-макрофагальной системы, именно в них часто обнаруживают эозинофильные гранулы.
Регуляция. Уровень эозинофилов регулируется с помощью автономной системы, механизм которой детально еще не изучен. Глюкокортикостероиды в значительной степени влияют на уровень циркулирующих эозинофилов, вероятно, за счет блокады стимула и торможения миграции клеток из костного мозга. Это приводит к резкому уменьшению содержания эозинофилов в тканях и периферической крови при их нормальном или повышенном уровне в костном мозге. При приеме высоких доз глюкокортикостероидов эозинофилы могут почти полностью исчезнуть из периферической крови. Гормональные препараты — эстрогены и андрогены — вызывают эозинофилию. Блокада бета-рецепторов приводит к увеличению содержания эозинофилов, поэтому некоторые авторы рассматривают причину эозинофилии при атопических заболеваниях в связи с блокадой бета-адренергических рецепторов. Хотя еще не получен точный ответ на вопрос, в какой форме осуществляется влияние парасимпатического нерва на эозинофилы, не вызывает сомнения факт, что их количественные сдвиги в организме регулируются вегетативной нервной системой. Это в свою очередь позволяет объяснить колебания уровня эозинофилов в крови в зависимости от суточного биоритма (минимум в утренние часы и максимум к полночи). Под влиянием «патологического» стимула процесс регуляции эозинофилов постепенно становится неконтролируемым.
Подвижность. За локальную эозинофилию в зоне аллергической реакции ответственны хемотаксические факторы. При IgE-опосредованных иммунных реакциях это в первую очередь относится к фактору хемотаксиса эозинофилов анафилаксии (ФХЭ-А). Низкие концентрации гистамина оказывают токсическое действие, более высокие дозы — подавляют эозинофилию. При влиянии на H1-рецепторы отмечают усиление миграции эозинофилов, на Н2-рецепторы — угнетение. Исследователи полагают, что через эти рецепторы действует также механизм регуляции атопической реакции.
LTB4 — это самое сильнодействующее соединение, влияющее на подвижность эозинофилов, правда, не в меньшей степени и на таксис нейтрофилов. При действии этого препарата повышается число С-рецепторов. Через 4 ч в зоне IgE-опосредованной аллергической реакции регистрируют эозинофилию. Второй пик наступает спустя 24-48 ч. Полагают, что эти проявления вызываются разными факторами. При экспериментальной модели Т-клеточной опосредованной иммунной реакции как при сенсибилизации, так и в случае введения разрешающих доз в лимфатических узлах животных выявляют эозинофилию. В настоящее время еще отсутствуют точные данные о медиаторах, ответственных за хемотаксическую активность. Лимфокин, обозначенный как «eosinophil stimulation promotor», стимулирующий таксис эозинофилов, по-видимому, содержит антигенные структуры. Он термостабилен. Вопрос о специфическом лимфокине остается открытым.
Регуляция процесса миграции эозинофилов осуществляется как через инактивацию хемотаксических факторов, так и через непосредственное воздействие на клетки. С3а- и С5а-компоненты комплемента инактивируются с помощью анафилотоксина-ингибитора и, вероятно, неидентичного «хемотаксического инактиватора», который влияет на целый ряд факторов. В этом отношении ФХЭ-А относительно стабилен. Природные ингибиторы до сих пор неизвестны.
Функция. Как С3а, так и С5а хемотаксически действуют на эозинофилы, но менее выражение и не столь селективно как ФХЭ-А. На основании опубликованных данных можно выделить две основные функции эозинофилов:
— цитотоксический эффект на возбудителей паразитарных инфекций;
— модуляция IgE-опосредованной и, вероятно, других аллергических реакций.
а) Цитотоксический эффект: эозинофилы действуют in vitro значительно сильнее, чем другие фагоциты, на многочисленных возбудителей паразитарных инфекций. Ответственными за этот эффект являются, во-первых, контакт через Fc-рецепторы, а также МВР и О2-радикалы, из которых исходит непосредственное цитотоксическое действие.
б) Модуляция аллергических реакций: эозинофилы прежде всего дают ингибирующий эффект при IgE-опосредованной реакции.
В эозинофилах содержатся следующие компоненты:
— гистаминаза (аналогично нейтрофилам), которая участвует в процессе окислительного, дезаминнрования гистамина;
— арилсульфатаза и пероксидаза, разрушающая лейкотриены;
— фосфолипаза D, инактивирующая ФАТ,
Относительно новые данные свидетельствуют о том, что эти эффекты в определенной мере уравновешиваются через механизмы, которые усиливают аллергическую реакцию. Так, эозинофилы продуцируют многочисленные лейкотриены, особо следует отметить LTC4 и ФАТ. Существенную роль они играют в замедленной фазе. Пероксидаза и МВР могут усиливать высвобождение медиаторов из тучных клеток и базофилов, Кортикоиды блокируют экспрессию Fc-рецепторов и процесс дегрануляции. Фосфолипаза может содействовать продукции простагландинов из липидов. Вероятно, реагинсодержащие иммунные комплексы абсорбируются главным образом на этих клетках. Еще не вполне ясно, каким способом происходит высвобождение эозинофильных факторов — в результате иммунной реакции (рецепторы для IgE), через иммунные комплексы, поглощаемые при фагоцитозе, или с помощью медиаторов других клеток.
Гомоцитотропные антитела класса IgG у человека. Известны сообщения, что у человека, как и у некоторых видов животных, могут вырабатываться данные антитела. Они обнаружены в более высоких концентрациях у страдающих атопическими заболеваниями, чем у здоровых лиц. Это отчасти объясняет данные, указывающие на гетерогенность гомоцитотропной активности, что было установлено ранее с помощью хроматографии.
Эти антитела сенсибилизируют кожу человека максимум на 24 ч, кожу обезьяны — примерно на 4 ч (антитела с коротким латентным периодом). Они были обнаружены при аллергии к молоку, поллинозах, сывороточной болезни (у лиц, не страдающих атопическими заболеваниями), а также при аллергических реакциях после введения столбнячного токсоида и при васкулитах, развившихся в результате стрептококковой инфекции. Антитела не инактивируются ни путем нагревания в течение 4 ч при 56 °С, ни обработкой 0,1 М раствором 2-меркаптоэтанола. После их контакта с антигеном может наступить реакция высвобождения гистамина, однако она выражена гораздо в меньшей степени, чем после пассивной сенсибилизации антителами IgE. Поскольку структура антител еще не изучена, то их обозначают как IgG-STS. Результаты изучения их блокирующего эффекта, а также свойств специфических антисывороток против разных субклассов IgG свидетельствуют о том, что скорее всего С4-антитела ответственны за аллергическую реакцию.
С помощью этих антител исследователи попытались прежде всего объяснить атопические проявления, при которых отсутствуют классические реагины (IgE). Уровень IgG и целом невысок. В тесте Прауснитца-Кюстнера, воспроизводимом на коже обезьян, максимальный титр достигает значения 1:16.
Было доказано связывание IgG на базофилах, однако не удалось вызвать индуцированное антигеном высвобождение гистамина из этих клеток. Эффект блокады рецепторов с помощью IgE показал, что связывание IgG-STS происходит на тех же самых рецепторах. Конкуренция рецепторов и снижение выхода медиаторов могут быть причинами десенсибилизации.
Источник