Значение наследственной предрасположенности к аллергии
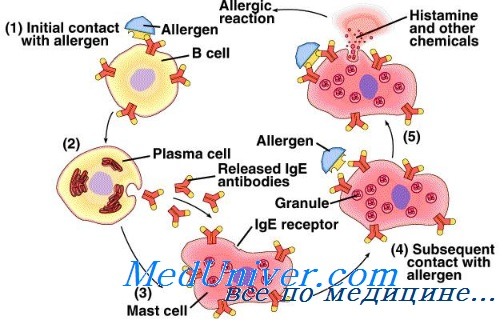
Наследственные причины аллергий. Генетика атопийСуществует наследственная предрасположенность к атопическим заболеваниям. Однако при таких заболеваниях, как бронхиальная астма, диффузный нейродермит и аллергический ринит, в развитии которых взаимодействуют наследственные и средовые факторы, крайне трудно выделить роль определенных генов. Клиническая картина при этих заболеваниях, по всей вероятности, определяется сложным взаимодействием многих генетических локусов, и характерная для любой атопической болезни вариабельность фенотипа зависит от изменений в каждом из этих локусов. Ситуация еще более осложняется тем, что разные аллергические заболевания могут иметь одни и те же генетические маркеры. Например, атопию часто выявляют по немедленной реакции на внутрикожное введение аллергенов и повышенному уровню IgE в крови, тогда как бронхиальная астма характеризуется повышенной реактивностью дыхательных путей. В основе аллергических заболеваний лежат изменения по крайней мере двух групп генов. Одни из них контролируют системные проявления атопии, общие для различных аллергических заболеваний (например, повышение синтеза IgE и эозинофилию), а другие определяют местные воспалительные реакции в отдельных органах-мишенях (например, в коже при диффузном нейродермите или в легких при бронхиальной астме). Исследование генома больных диффузным нейродермитом выявили ассоциацию этого заболевания с изменением в хромосомах lq21,3q21, 17q25 и 20р. Эти участки тесно связаны с известными локусами псориаза. Локус lq21 содержит кластер генов, влияющих на дифференцировку эпидермиса. Главные подходы к выявлению генов, ответственных за атопические болезни, включают 1) идентификацию генов-кандидатов, основанную на поиске полиморфизмов, способных изменять функцию или экспрессию известных генов, продукты которых участвуют в патогенезе атопии или воспаления; 2) позиционное клонирование специфических областей хромосомы, ассоциированных с наследованием болезни. Физическое картирование этих областей позволяет идентифицировать локализованные в них гены. Затем гены-кандидаты исследуют на предмет наличия мутаций или специфических полиморфизмов. Известно несколько генов-кандидатов, ассоциированных с атопическими болезнями. Сцепление и значительную ассоциацию с атопическими заболеваниями обнаруживают отдельные аллели генов на хромосомах 5, 6, 11, 12 и 14.
Хромосома 5. Сегмент 5q23-35 содержит несколько генов, возможно, причастных к патогенезу аллергических заболеваний. К ним относятся тены, кодирующие цитокины Тh2-клеток (ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-9, ИЛ-13 и ГМ-КСФ). В качестве кандидата особенно подробно исследован ген ИЛ-4. Замена цитозина на тимидин в положении 589 промоторной области гена ИЛ-4 приводит к появлению необычного сайта связывания фактора транскрипции NF-AT (ядерный фактор активированных Т-клеток), повышению сродства его связывания, усилению транскрипции гена ИЛ-4 и возрастанию продукции IgE. Это согласуется с важной ролью ИЛ-4 в развитии Тh2-клеток и переключении синтеза классов иммуноглобулинов на синтез IgE. К другим генам этой хромосомы, способным влиять на развитие аллергических реакций, относятся гены синтазы лейкотриена С4, гены рецептора М-ГСФ, глюкокортикоидного рецептора и b2-адренорецептора. Хромосома 6. На этой хромосоме расположены гены, кодирующие HLA I и II классов, которые регулируют специфичность и интенсивность иммунного ответа на специфические аллергены. Здесь локализованы и гены, играющие центральную роль в процессе распознавания и представления антигенов, в том числе гены транспортеров, участвующих в обработке антигенов (ТАР). Реакции IgE на специфические аллергены (такие, как антиген амброзии Amb a V и аллерген пылевого клеща Der p 1) сцеплены с определенными локусами HLA класса II. На хромосоме 6 находится и ген ФНО-а — главного цитокина, участвующего в привлечении клеток в очаг воспаления. Найдена ассоциация полиморфизмов гена ФНО-а с бронхиальной астмой. Хромосома 11. Рядом исследований доказана связь атопии с сегментом Hql3. В качестве расположенного здесь гена-кандидата рассматривается ген, кодирующий |3-субъединицу высокоаффинного рецептора IgE (FceRI-b), которая ускоряет проведение внутриклеточного сигнала от этого рецептора. Обнаружена ассоциация нескольких генетических вариантов FceRI-b с бронхиальной астмой, повышенной реактивностью бронхов и диффузным нейродермитом. Хромосома 12. Бронхиальная астма и другие атопические заболевания связаны и с особенностями хромосомы 12. На ее длинном плече локализуется ряд генов-кандидатов — ИФН-у, NO-синтазы, ФСК, STAT-6, ИФР-1 и b-субъединицы ядерного фактора-Y. ИФН-у способствует развитию Тh1-клеток и угнетает функцию Тh2-клеток; STAT-6 активируется ИЛ-4 и принимает участие в индукции переключения синтеза иммуноглобулинов на синтез IgE и дифференцировке Тh2-клеток, а ФСК поддерживает пролиферацию и дифференцировку тучных клеток. Другие хромосомы. На хромосоме 14 локализован ген ос-цепи TCR, которая играет важную роль в распознавании аллергенов. Обнаружена выраженная ассоциация реакций IgE на ряд аллергенов и общего уровня IgE в сыворотке крови с некоторыми ос-изотипами TCR, свидетельствующая о роли этого гена в модификации специфических реакций IgE. Найдена также связь между атопией и усиливающим функцию полиморфизмом гена а-субъединицы рецептора ИЛ-4, который расположен на хромосоме 16. Имеются данные и о связи бронхиальной астмы с сегментами 17р12—qll.2, где локализованы гены, кодирующие хемокины RANTES и эотаксин, которым принадлежит основная роль в привлечении эозинофилов в дыхательные пути при бронхиальной астме. Гены могут влиять на течение аллергических заболеваний и иными путями, определяя, например, эффективность лечения кортикостероидами, b2-адреномиметиками и средствами, изменяющими метаболизм лейкотриенов. По некоторым данным, присутствие глутамата в положении 27 b2-адренорецептора ассоциировано с меньшей реактивностью дыхательных путей при бронхиальной астме. Присутствие глицина в положении 16 этого рецептора ассоциировано с ночным падением ОФВ1. Полиморфизм промотора гена 5-липоксигеназы сказывается на синтезе лейкотриенов. Наконец, полиморфизм промотора гена ИЛ-4 с ускорением его транскрипции ассоциирован с резистентностью к кортикостероидам и тяжелым течением бронхиальной астмы. В связи с этим следует отметить, что совместное воздействие ИЛ-2 и ИЛ-4 придает Т-лимфоцитам резистентность к кортикостероидам. — Также рекомендуем «Эпидемиология (распространенность) аллергических заболеваний — атопий» Оглавление темы «Аллергические реакции у детей»:
|
Источник
Аллергия является следствием повышенной чувствительности иммунитета, а тот факт, что аллергия весьма эффективно «распространяется среди членов семьи, свидетельствует о том, что предрасположенность к ее развитию передается генетически. Очень часто механизм возникновения аллергии называется атопия, когда организм начинает вырабатывать повышенное количество иммуноглобулинов IgE.
Атопия в семье
Атопия встречается у 20% населения. Если оба родителя имеют атопию, то вероятность того, что ребенок будет ее иметь, составляет 50%, она возрастает еще больше когда у обоих родителей аллергия проявляется схожим образом. Самый низкий риск рождения ребенка с атопией в семье незнакомой с этой болезнью и составляет около 13%.
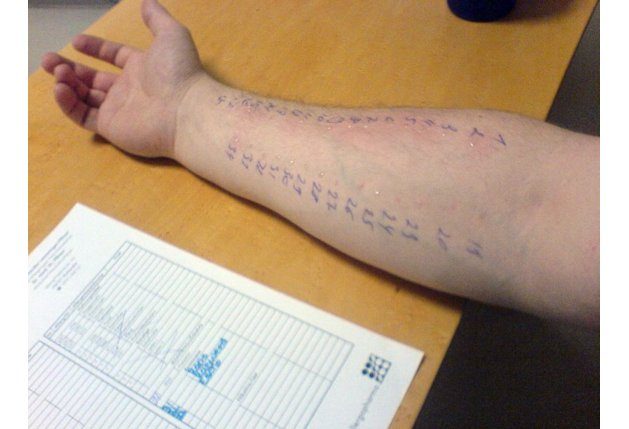
Кожные аллергические тесты помогают в диагностике сложных аллергий
Wolfgang Ihloff, lic. CC BY SA
Наследование предрасположенности к аллергии не зависит от одного конкретного гена, в этом участвует набор генов. Найдено несколько десятков мест в генетическом коде человека, которые несут за это ответственность. Участие в развитии аллергии одних слабее, других сильнее. Ключевым местом является пятая Х-хромосома. В ней есть места, контролирующие производство различных белков и веществ в организме, которые могут принимать участие в аллергической реакции. В частности, производство антител, которые играют ключевую роль в развитии аллергии.
Если оба родителя аллергики, то в 66% случаев ребенок может получить аллергию. Если больна, мама, ребенок имеет риск в 40%, а если папа – 30%.
Инфекции и аллергия
Влияние инфекций на возникновение симптомов аллергии неоднозначно. Некоторые виды инфекций повышают вероятность развития аллергического процесса. У маленьких детей частой их причиной являются вирусы, а наиболее распространенный из них – РСВ. Однако существует множество исследований, показывающих, что частый контакт с микроорганизмами, животными и их выделениями играет защитную роль. Это так называемая гигиеническая гипотеза, которая говорит о том, что дети, живущие в условиях низкой гигиены, например, в сельской местности, в больших семьях, обучающиеся в яслях или детском саде реже заболевают аллергией. Это, однако, косвенные выводы, и в связи с ними не стоит отказываться гигиенических привычек.
Без сомнения, важную роль играют условия среды, в которой растет ребенок. Если он унаследовал склонность к атопии и живет в среде, где сталкивается с сигаретным дымом – вероятность развития у него астмы оценивается в 25%. А когда живет в чистой среде, риск этого заболевания сокращается в несколько раз. Другим фактором, который способствует развитию астмы, являются выхлопные газы автомобилей: дети, живущие в городе, чаще страдают от астмы.
Существенное влияние имеют также другие заболевания. К группе таких заболеваний, кроме астмы относятся: хроническая обструктивная болезнь легких, серьезные аллергические реакции в прошлом, полипы полости носа, частые инфекции пазух носа, верхних дыхательных путей, атопический дерматит, пищевая аллергия.
Контакт с аллергенами
Вторым фактором, который вызывает это заболевание является контакт с аллергенами. Напомним, что аллергеном является вещество, вызывающая у предрасположенного к этому человека аллергические симптомы. У других людей – здоровых – эти вещества не будут вызывать никаких реакций.
Потенциальные аллергены находятся везде. Огромное количество частиц, присутствующих в природе, может вызывать аллергические реакции. Это вещества, как природного происхождения, так и синтезированные человеком. Только аллергики реагируют на контакт с аллергенами. Они могут действовать на клетки нашего организма несколькими путями. Путем вдыхания, поедания или через непосредственный контакт с кожей и слизистыми оболочками.
Виды аллергенов
Ингаляционные аллергены вызывают, прежде всего, заболевания дыхательной системы. Чаще всего, это пыльца растений. Ее производят в больших количествах растения в весенне-летний период. Из года в год интенсивность пыльцеобразования, может варьироваться. Как известно, конкретные растения производят пыльцу только в определенные месяцы и это знание помогает идентифицировать аллерген. Если симптомы аллергии появляются в период с марта до мая, – вероятно, вы страдаете аллергией на пыльцу деревьев, лещины, ольхи, ивы, а если «течет» из носа в июне, июле и августе – у Вас аллергия на траву. Другие ингаляционные аллергены, такие как клещи домашней пыли, шерсть животных, плесень, тараканы, не имеют сезонного цикла и могут спровоцировать появление симптомов в течение всего года.
Пищевые аллергены составляют большую группу различных веществ: орехи и арахис, рыба, ракообразные, пшеница, яйца, молоко, соя и различные фрукты. Также сюда относятся добавки к пище, содержащие бензоаты, сульфиты, глутамат натрия и, кроме того, множество лекарств.
Это не означает, что пищевые аллергены вызывают симптомы только со стороны желудочно-кишечного тракта, их потребление может также вызвать аллергические реакции во всем организме, такие как анафилактический шок или сыпь на коже.
Некоторые продукты или растения, присутствующих в окружающей среде имеют похожее строение, хотя это не очевидно. Например, береза похожа по молекулярному устройству на яблоки. Если у Вас имеется аллергия на березу, то после контакта с частицами яблока у Вас также могут появиться аллергические симптомы, например, отек и зуд слизистых оболочек полости рта.
Другие схожие вещества приводятся в таблице:
Деревья, например, сосна | Яблоки, орехи, киви, красный перец |
Травы | Мука, помидоры, орехи, сельдерей, дыня |
Полынь | Морковь, сладкий перец, тмин, ромашка, подсолнухи, мед |
Перья | Куриные яйца |
Клещи | Креветки, улитки, омары |
Грибки, плесень | Молоко, сыр с плесенью, пахта, йогурт |
Ферменты насекомых | Мёд |
Латекс | Авокадо, киви, бананы, ананасы, апельсины |
Факторы психики в развитии аллергии
Всё чаще говорят о роли психических факторов, которые, по мнению одних специалистов вызывают аллергии, а по другим только их усиливают или являются их следствием. В формировании и развитии сенсибилизации обвиняют все «негативные эмоции»: агрессию, страх, гнев, стресс. Ряд исследований подтверждает сосуществование аллергических заболеваний с тревожными расстройствами, депрессией, раздражительностью или повышенной эмоциональной чувствительностью.
Ещё до недавнего времени считалось, что аллергию на пыльцу имеют дети только с 7 лет, и только те, которые в детстве проявляли симптомы пищевой аллергии. Последние исследования показывают, однако, что симптомы аллергии на пыльцу могут начаться как в возрасте 3-х лет, так и в более поздний период жизни, даже после 50 лет. Проявления аллергии могут сильно варьироваться с возрастом – симптомы могут вовсе исчезать, могут присоединяться новые аллергены или даже может увеличиваться аллергическая чувствительность.
Источник
Многочисленны
встречающиеся в природе и образующиеся
в организ¬ме аллергены, многообразны
и проявления аллергических заболеваний,
однако в механизме развития их много
общего, поэтому современные классификации
аллергии основаны на их патогенетических
механизмах. Согласно принятой в настоящее
время классификации все аллергические
реакции могут быть разделены на две
большие группы:
Аллергические
реакции немедленного типа, протекающие
преимущественно в жидких средах
организма с участием реакции аллерген
— антитело.Аллергические
реакции замедленного типа, протекающие
на клеточном уровне, преимущественно
с участием Т-лимфоцитов.
Общим
признаком для всех видов аллергии
немедленного типа является быстрота
их развития. Так, кожная аллергическая
реакция развивается через несколько
минут после внутрикожной инъекции
аллергена. При аллергии замедленного
типа она появляется через 24—48 ч.
К
аллергическим реакциям немедленного
типа относятся анафилаксия, сывороточная
болезнь, поллинозы (сенная лихорадка),
крапивница, отек Квинке и др.
К
аллергическим реакциям замедленного
типа относятся: реакции туберкулинового
типа (бактериальная аллергия), аллергические
реакции контактного типа (контактный
дерматит), некоторые формы лекарственной
аллергии, многие аутоаллергические
заболевания (энцефалит, тиреоидит, орхит
и др.), аллергические реакции отторжения
трансплантата.
Наследственная предрасположенность к аллергии
В
настоящее время установлено, что
предрасположение к аллергии наследуется.
Аллергическая предрасположенность или
аллергическая конституция передается
по наследству несколькими генами.
Например, для бронхиальной астмы
предполагают участие но крайней мере
двух пар генов. У мышей ген Ir (immunological
reactivity) располагается в локусе гена
тканевой несовместимости — Н2. У человека
этот ген локализуется в области гена
HL-A2 и некоторых других.
Аллергическая
предрасположенность наследуется нередко
по доминантному типу и обладает большой
пенетрантностью. Если в семье хотя бы
один из родителей болен аллергией,
появление ее можно ожидать у ребенка.
Предрасположенность выявляется в разных
формах. У родителя, например, она может
быть в форме астмы, у детей в форме кожных
аллергозов, анафилаксии и других
проявлений.
Аллергия
Патологическая
физиология
Под.
ред. А. Д. Адо и Л. М. Ишимовой
М.: Медицина, 1980

Анафилаксия
Термин
«анафилаксия» означает «беззащитность»
(греческое ana — обратное, противоположное
действие и phylaxis — охранение, защита).
Анафилаксия — это состояние приобретенной
повышенной чувствительности к действию
какого-либо чужеродного белка —
анафилактогена.
Анафилаксию
впервые наблюдали у собак французские
ученые Рише и Портье (1902), а у морских
свинок — Г. П. Сахаров (1905). Реакцию,
возникающую после повторной (так
называемой «разрешающей») инъекции
чужеродного белка, А. М. Безредка (1912)
назвал анафилактическим шоком.
Развитие
анафилаксии как у человека, так и у
животных складывается из трех
последовательных процессов:
сенсибилизации
(подготовка);анафилактического
шока (разрешение);десенсибилизации
Сенсибилизация
— от латинского sensibilis — чувствительный,
процесс постепенного повышения
чувствительности к аллергену после
внедрения его в организм.
Сенсибилизация
может быть активной и пассивной.
Активная
сенсибилизация возникает
при введении чужеродного белка в организм
животного парентеральным путем
(внутримышечно, подкожно, в подушечки
лапок, в брюшную полость, в спинномозговую
жидкость, ингаляционным путем и т. д.).
Для сенсибилизации достаточно очень
небольшого количества аллергена —
порядка сотых и тысячных долей грамма.
Состояние повышенной чувствительности
возникает не сразу после инъекции
аллергена, а через 10-—14 дней, сохраняется
у животных в течение 2 мес и больше, а
затем постепенно исчезает. У человека
сенсибилизация может сохраняться в
течение многих месяцев и лет.
В
процессе сенсибилизации усиливается
фагоцитарная активность клеток
ретикулоэндотелиальной системы,
начинается плазматизация лимфоидных
клеток и выработка в них антител.
С
первых же дней сенсибилизации в стволах
соматических и вегетативных нервов
наблюдается увеличение возбудимости,
функциональной подвижности, укорочение
хронаксии. Рецепторы внутренних органов
и кровеносных сосудов претерпевают
фазные изменения, возбудимость их
вначале повышается, а в дальнейшем
угнетается.
Пассивная
сенсибилизация возникает
при введении здоровому животному
(реципиенту) сыворотки другого активно
сенсибилизированного животного (донора).
Состояние повышенной чувствительности
возникает через 18—24 ч после введения
сыворотки. Это время необходимо для
того, чтобы антитела, содержащиеся в
сыворотке донора, успели фиксироваться
в тканях реципиента.
Пассивно
сенсибилизировать можно и изолированные
из организма органы (кишечник, матка,
легкие и др.), помещая их в среду с
антителами; введение готовых антител
в кожу вызывает ее локальную пассивную
сенсибилизацию. Состояние пассивной
сенсибилизации не стойко и проходит
довольно быстро.
Анафилактический
шок возникает
в ответ на повторное (разрешающее)
введение анафилактогена сенсибилизированному
животному — морской свинке, кролику,
собаке и др.
Разрешающее
введение анафилактогена (чужеродной
сыворотки) производится в кровь в
количестве, превышающем примерно в 10
раз сенсибилизирующую дозу сыворотки
как у активно, так и у пассивно
сенсибилизированных животных. У различных
животных характер анафилактического
шока имеет свои особенности.
Морская
свинка после
введения разрешающей дозы сыворотки
начинает беспокоиться, почесывает
мордочку, на ней взъерошивается шерсть.
Затем появляется одышка, непроизвольное
мочеиспускание, дефекация, судороги.
Свинка падает на бок. Одышка нарастает.
Животное погибает при явлениях асфиксии
от паралича дыхательного центра.
Кровяное
давление во время шока сначала повышается,
в конце шока падает вследствие паралича
сосудодвигательного центра. В крови
наблюдается лейкопения, эозинофилия,
активируются фибринолитические свойства
крови, падает активность комплемента
— C3, С5 (Н. Н. Сиротинин).
На
вскрытии погибшей от анафилактического
шока морской свинки находят очаги
эмфиземы и ателектаза в легких, застой
крови в правом сердце, селезенке. Вздутые
вследствие спазма гладких мышц бронхиол
легкие обычно закрывают сердце.
У
собаки
существенное
значение в динамике анафилактического
шока имеют расстройства портального
кровообращения и застой крови в печени
и сосудах кишечника. Поэтому анафилактический
шок у них протекает по типу острой
сосудистой недостаточности, но лишь в
редких случаях бывает смертельным.
Наблюдается резкое замедление свертывания
крови вследствие выбрасывания из тучных
клеток гепарина. Возникает лейкопения.
У
кроликов
ведущим
расстройством в патогенезе анафилактического
шока является застой крови в малом круге
кровообращения. Застойные явления в
малом круге сопровождаются развитием
отека легких и острой недостаточности
правого сердца. Резкая лейкопения
возникает вследствие скопления лейкоцитов
в капиллярах легких.
Десенсибилизация
—
состояние, которое возникает у животного,
перенесшего несмертельный анафилактический
шок. Если вскоре после шока животному
вновь ввести ту же самую чужеродную
сыворотку, то никакой реакции не будет.
Шок
не возникает, если разрешающую дозу
аллергена ввести в ранние сроки
сенсибилизации (7—8 дней). У этого
животного не будет шока и в оптимальные
сроки сенсибилизации — через 2—3 нед
от начала сенсибилизации, т.е. возникает
десенсибилизация. Десенсибилизацию
можно получить и в поздние сроки
сенсибилизации путем введения антигена
малыми дозами подкожно или внутримышечно.
Состояние десенсибилизации у морской
свинки длится 2 нед и больше, а у кролика
— всего 3—4 дня.
Анафилактический
шок не возникает, если сенсибилизированной
морской свинке разрешающую дозу аллергена
ввести в кровь под наркозом. После выхода
из наркоза животное оказывается
десенсибилизированным. А. М. Безредка
объяснял десенсибилизирующее действие
наркотиков тем, что клетки центральной
нервной системы не реагируют на продукты
взаимодействия аллергена с антителами.
Снижение
чувствительности сенсибилизированного
организма к специфическому аллергену
при повторных инъекциях его используется
в клинике для лечения аллергических
болезней. Специфическая гипосенсибилизация
проводится путем повторных парентеральных
введений больному (чаще всего внутримышечно
или подкожно) небольших доз специфического
аллергена. Постепенно чувствительность
больного к аллергенам снижается.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
